Page 9 - Boletin SEHH Mayo - Junio 2016
P. 9
noticias
Hematólogos del GELMC lideran un proyecto pionero dirigido a la prevención de efectos adversos
El documento de recomendaciones ha sido publicado en el último número de Leukemia
“El tremendo éxito que han tenido los inhibidores de tiro- sina cinasa en el tratamiento de la leucemia mieloide cró- nica (LMC) nos ha colmado de satisfacción respecto a su efi- cacia”, afirma el doctor Juan Luis Steegmann Olmedillas, presidente del Grupo Español de LMC de la SEHH.
Tras 15 años de experien- cia, un panel de expertos de la European Leukemia Net (ELN) ha elaborado el primer documento de recomenda- ciones para la gestión y pre- vención de efectos adversos en el tratamiento de la LMC, que “describe la cinética de aparición de los efectos ad- versos –con el fin de que el hematólogo esté vigilante– y da consejos sobre cómo evi- tarlos y tratarlos”. Este con- senso ha sido publicado en el último número de la revis- ta Leukemia.
Los hematólogos piden un mayor estímulo institucional para fomentar la investigación clínica en España
La investigación clínica “es el mejor medio para aumentar el conocimiento médico aplicado al paciente; en el caso concreto de los ensayos clínicos, también permite tener acceso a fármacos innovadores”, apunta el profesor Jesús San Miguel, director de Medicina Clínica y Traslacional de la Clínica Universidad de Navarra y miembro destaca- do del Programa Español de Tratamientos en Hematología (PETHEMA) de la SEHH. Con motivo del Día Mundial del
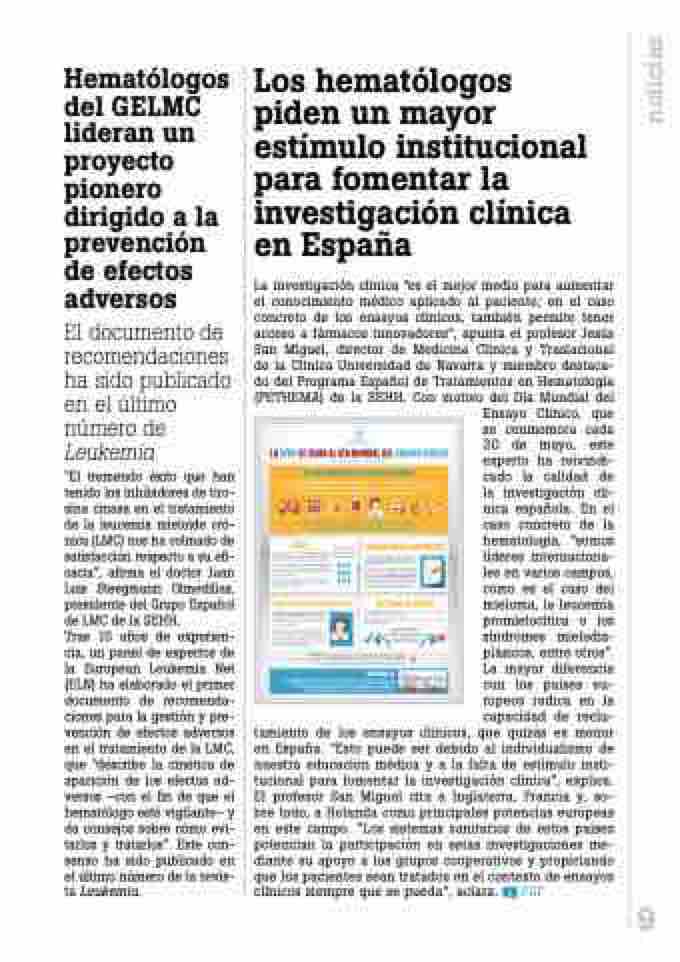
La SEHH SE Suma aL Día munDiaL DEL EnSayo CLíniCo 20 DE mayo DE 2016
En QuÉ ConSiSTEn LoS EnSayoS CLíniCoS
Son estudios de investigación médica de nuevos fármacos que reclutan a voluntarios, tanto sanos como pacientes. Se prueban nuevos tratamientos o se comparan diferentes tipos de aplicación de tratamientos ya existentes. Es la única manera de evaluar qué es efectivo para los pacientes y con qué riesgo.
El 40% de los ensayos clínicos en España se dirigen a enfermedades de la sangre
Ensayo Clínico, que se conmemora cada 20 de mayo, este experto ha reivindi- cado la calidad de la investigación clí- nica española. En el caso concreto de la hematología, “somos líderes internaciona- les en varios campos, como es el caso del mieloma, la leucemia promielocítica o los síndromes mielodis- plásicos, entre otros”. La mayor diferencia con los países eu- ropeos radica en la capacidad de reclu-
Fases
Fase I: se determina la dosis máxima tolerada de un nuevo fármaco o combinación de medicamentos, que no han sido previamente usados en humanos. Fase II: se determina la tasa de respuesta de un nuevo agente simple o de una combinación de medicamentos, que ya ha superado previamente la fase I del ensayo.
Fase II: se separa a los pacientes en grupos (ramas), con el objeto de comparar una o más terapias con el tratamiento estándar.
Los pacientes, pieza clave de la investigación
Consentimiento informado
Es una parte vital del proceso de investigación y es de obligado cumplimiento por ley para cada participante en un ensayo clínico. Requiere que el investigador clínico informe convenientemente al paciente para que éste sea consciente de su implicación voluntaria y no coaccionada en un proceso de estudio, y para que adquiera toda la información necesaria y el entendimiento de las implicaciones que conlleva la inclusión en un ensayo clínico.
Criterios de acceso
De inclusión: determinan qué características deben tener los pacientes que vayan a participar en el estudio.
De exclusión: determinan cuándo un paciente no es apto para ser incluido en un estudio.
edad, comorbilidad,
etapa de la enfermedad, tratamientos recibidos con anterioridad, enfermedades previas, resultados del laboratorio
¿Cómo se accede a un ensayo clínico?
El médico es la persona más indicada para proponer al paciente la participación en aquellos ensayos clínicos que puedan resultarle beneficiosos, si éste cumple los requisitos necesarios.
Si el paciente conociese de la existencia de algún ensayo clínico que se estuviera llevando a cabo y que podría ser beneficioso para tratar su enfermedad, en todo momento la persona de referencia será su médico, quien le dirá si cumple los criterios necesarios.
PETHEma (Programa Español de Tratamientos en Hematología) es el grupo cooperativo de investigación más importante con que cuenta la SEHH. Actualmente tiene en marcha un total de 37 ensayos clínicos.
HEmoTRiaL.ES
Una plataforma promovida por la SEHH, cuyo objetivo es facilitar la búsqueda de información sobre los ensayos clínicos abiertos en España en el ámbito de la Hematología y Hemoterapia, tanto a los hematólogos y profesionales de especialidades afines como a los pacientes y sus familiares.
tamiento de los ensayos clínicos, que quizás es menor en España. “Esto puede ser debido al individualismo de nuestra educación médica y a la falta de estímulo insti- tucional para fomentar la investigación clínica”, explica. El profesor San Miguel cita a Inglaterra, Francia y, so- bre todo, a Holanda como principales potencias europeas en este campo. “Los sistemas sanitarios de estos países potencian la participación en estas investigaciones me- diante su apoyo a los grupos cooperativos y propiciando que los pacientes sean tratados en el contexto de ensayos clínicos siempre que se pueda”, aclara. PDF
9